1.嵌锂热力学

Li/Li x Mn 2 O 4 (0<x<2)电池的放电机理是锂在[Mn 2 O 4 ] 中的电化学嵌入反应。整个电池反应表示为:xLi+[Mn 2 O 4 ]⇌Li x Mn 2 O 4
在包埋反应中,电池的电动势随包埋深度x的变化而变化,因此电池反应自由能的变化应取电动势的积分形式:△G in
= -nF∫ x 0 E ( x)dx
嵌入的偏摩尔熵ΔS ~ in 和偏摩尔焓ΔH ~ in 分别为:
△S ~ in =F(əE/əT) x
ΔH ~ in =F[(əE/əT) x -E]
2. 嵌锂反应过程中的自由能变化
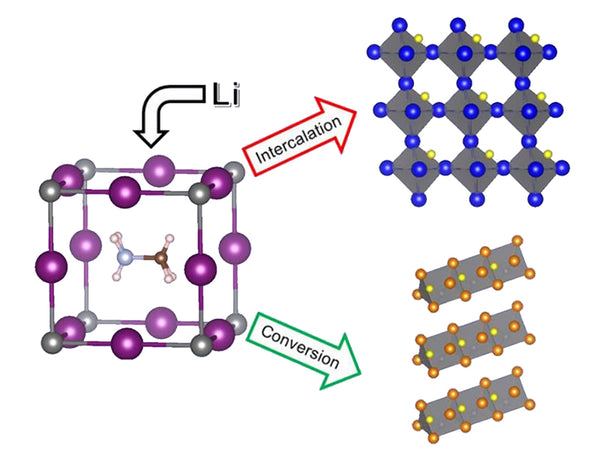
图1为Li/Li x Mn 2 O 4 电池在30℃时的库仑滴定曲线[EMF(x)]。在1<x<2区间,电压分别为4.1V、3.95V和2.97V,呈现三个平台,均高于常规氧化还原反应计算的电池电动势。
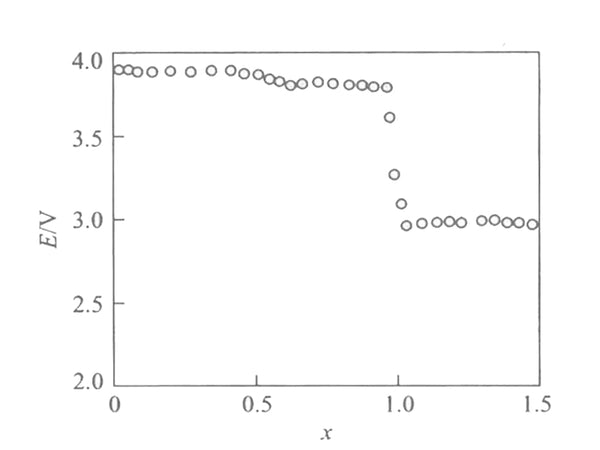
图1 Li/Li x Mn 2 O 4 电池在30℃时的EMF(x)曲线
以[Mn 2 O 4 ]为正极材料,Li/Li x Mn 2 O 4 电池完全放电,正极最终产物为Mn和Li 2 O。整个反应可表示为:
8Li+ [Mn 2 O 4 ]→4Li 2 O+2Mn
根据传统氧化还原反应的热力学计算,反应自由能变为-1313k/mol;如果该反应以电化学方式实现,则可通过对整个放电区间内的EMF(x)曲线进行积分得到反应的自由能,计算值为-1248kJ/mol。这个变化值与上式计算结果比较吻合,可以认为锂在[Mn 2 O 4中的嵌入反应]是整个反应的一个中间过程,即x<2时的高电动势是上述反应的总能量在反应的各个过程中重新分配的结果。这是因为如果反应按上式进行,必然涉及[Mn 2 O 4 ]晶格的破坏和Li 2 O晶格的形成,需要吸收能量,而锂插入[ Mn 2 O 4 ] 由于反应不涉及晶格的破坏和形成,避免了晶格能量的损失。
3.嵌锂的偏摩尔熵和偏摩尔焓
图2为不同嵌入深度的Li/Li x Mn 2 O 4 电池在不同温度下的EMF(x)曲线。
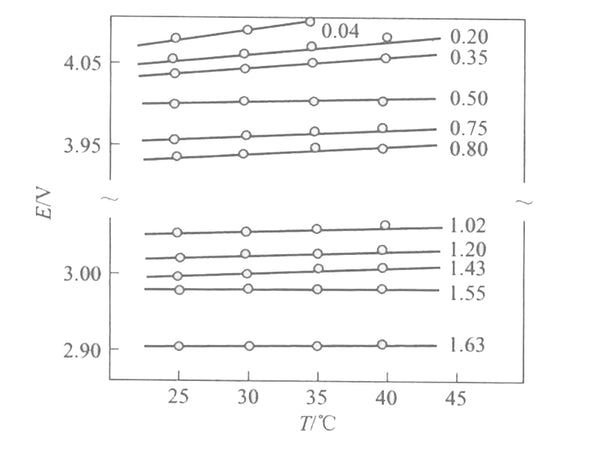
图2 不同嵌入深度的Li/Li x Mn 2 O 4 电池在不同温度下的EMF(x)曲线
根据公式ΔH ~ in =F[(əE/əT) x -E],不同嵌入深度下的偏摩尔扇如图3所示。文献报道当嵌入深度较小时(x <0.1),包埋反应的偏摩尔熵很大,约为60-100J/(mol·K)。反映出锂在[Mn 2 O 4 ]晶格中具有较大的自由度和较高的流动性。当 x 增加时,偏摩尔熵减小。另外,在x=1/2和x=1处有两个极小值,说明在x=1和x=1/2时embedding过程发生了变化。从Li x Mn 2 O 4的结构分析 (0<x<2),可见当x=1时,四面体8a的位置已经被占据,如果此时再有更多的锂嵌入,必然会进入八面体的16c位置。此时,[Mn 2 O 4 ]的晶体结构由立方晶变为四方晶,空间群由Fd3m变为F4 1 /ddm,导致嵌入偏摩尔熵发生巨大变化, x=1/2 处的最小值是 [Mn 2 O 4] lattice的上层结构是有关系的,就是有一个sub-lattice的问题。这时候整个晶体就出现了长程有序,不再是短程有序。恰好一个子晶格是满的,另一个是完全空的,宏观上看起来,当x=1/2时,晶胞参数有一个突然的跳跃。
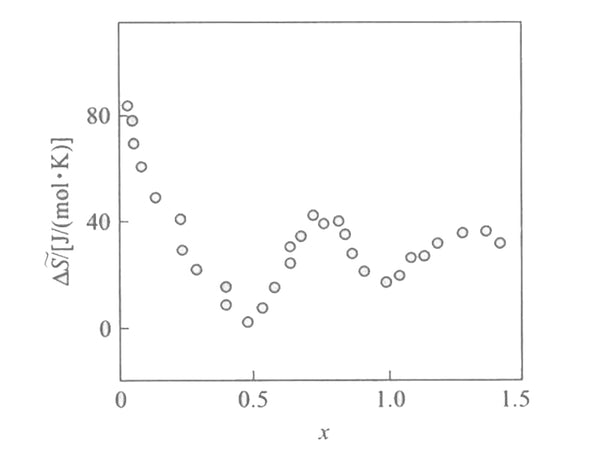
图3 偏摩尔熵与嵌入深度的关系
根据EMF(x)曲线和偏摩尔熵数据,可得到[Mn 2 O 4 ]中嵌锂反应的偏摩尔焓与插入深度的关系,如图4所示。可见,锂与[Mn 2 O 4 ]晶格之间的键合力很强,当x=1/2和x=1时,分摩尔焓达到最大值。x<1时的偏摩尔熔化值与x>1时的偏摩尔熔化值差异很大,反映出锂进入了两个不同的晶格位置。
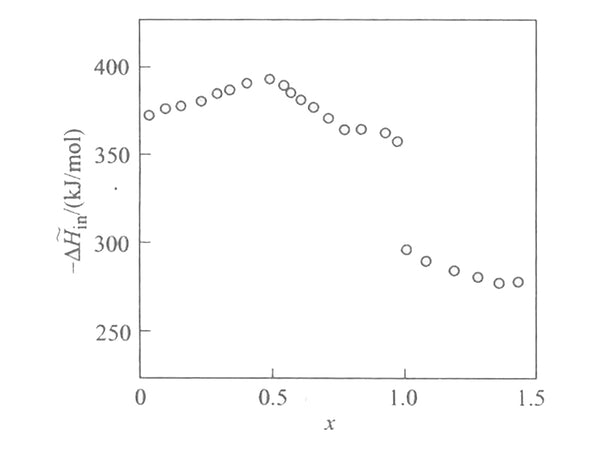
图4 嵌入偏摩尔焓与嵌入深度的关系
联系人:余工
手 机:198-5307-5821
邮 箱:batteryltd@sina.com