1. LiCoO 2材料
正极材料L.iMO 2 (M=Ni, Co)的组成式为层状岩盐结构(α-NaFeO 2结构),属于R3m族,如图1所示。它们都有一个基本骨架,其中氧离子以 ABC 堆的立方密堆积排列排列。LiNiO 2和LiCoO 2阴阳离子数相同,氧八面体间隙被阳离子占据。它们具有二维结构,Li +和Co 3+(或Ni 3+)在立方结构的(111)面上交替排列,并使晶格畸变变为六方对称。李+和Co 3+(或Ni 3+)分别位于(3a)和(3b)位置,O 2-位于(6c)位置。以LiCoO 2为例,由于Li、Co和O原子的相互作用而存在差异。因此,在…Li-O-Co-O-Li-O…层中,Co 3+和O 2-之间存在最强的化学键, O-Co-O层通过Li +静电相互作用结合在一起,所以整个晶胞结构是稳定的。相反,O层更靠近Co层(层间距μ=0.260nm),其中(003)面是其最可能的解理面。
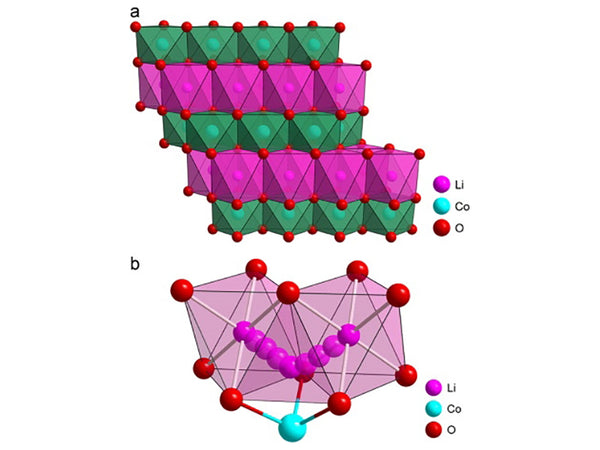
图1 正极材料LiCo O 2的结构示意图
从图1可以看出,在这种复合材料的结构中,锂和中心过渡金属原子分别形成平行于氧原子层的分离层,它们相互堆叠形成六方超晶格。它们的晶格常数在表 1 中给出。
| 化合物 | 0 /纳米 | c 0 /纳米 | 体积/nm 3 | rLi+/rM 3+ | 晶体对称性 |
| 钴酸锂O 2 | 0.2805 | 1.406 | 0.0319 | 1.314 | 六方晶系(R3m) |
| LiNi O 2 | 0.2885 | 1.420 | 0.0341 | 1.286 | 六方晶系(R3m) |
表1 LiM O 2 (M=Ni,Co)晶格常数数据
LiCoO 2具有三相,即HT-LiCoO 2的层状结构、LT-LiCoO 2的尖晶石结构和LiCoO 2的岩盐相。LiCoO 2层状结构中氧原子采用扭曲立方密堆积,钴层和锂层交替分布在氧层两侧,占据八面体孔隙;尖晶石结构的LiCoO 2氧原子呈理想的立方密排排列,锂层含有25%的钴原子,钴层含有25%的锂原子。Li +和Co 3+随机排列在岩盐相晶格中,锂层和钴层无法清晰区分。
层状CoO 2骨架结构为锂原子的迁移提供了二维隧道。电池充放电时,Li +在活性物质中的迁移过程可用下式表示:
充电:LiCoO 2 →xLi + +Li 1 ̄x CoO 2+xe
放电:Li 1 ̄x CoO 2 + yLi + +xe→Li 1_x+y CoO 2 (0<x≤1, 0<y≤x)
HT-LiCoO 2和LT-LiCoO 2在充放电过程中的结构变化和电化学性能并不一致。充电时,随着x从0增加到0.5,HT-LiCoO 2的晶胞参数c/a从5.00增加到5.14。在x≈0.5时,HT-LiCoO 2由六方晶胞转变为单斜晶胞;而LT-LiCoO 2晶胞参数c/a几乎没有变化(见表2)。
| 样本 | 一个/纳米 | 厘米/纳米 | c/a |
| 高温钴酸锂 | 0.2816(2) | 1.408(1) | 5.00 |
| HT-Li0.74 Co O 2 | 0.2812(2) | 1.422(1) | 5.06 |
| HT-Li0.49Co O 2 | 0.2807(2) | 1.442(1) | 5.14 |
| LT-LiCo O 2 | 0.28297(6) | 1. 3868(4) | 4.90 |
| LT-Li 0.71 Co O 2 | 0.28304(4) | 1. 3866(2) | 4.90 |
| LT-Li 0.49 Co O 2 | 0.28273(2) | 1.3851(1) | 4.90 |
表2 HT-LiCo O 2和LT-LiCo O 2的晶胞参数数据及其脱锂状态
与HT-LiCoO 2 /Li组合电池相比,LT-LiCoO 2 /Li电池工作电压低,在一些非水电解液中稳定。然而,LT-LiCoO 2锂层中的钴原子会阻碍锂原子的可逆脱嵌,导致LT-LiCoO 2中Li+的传质速率变慢;LT-Li 1-x CoO 2脱锂时反应活性高,极易在电极表面形成钝化膜,因此LT-LiCoO 2材料难以实现实用化。
2. LiNiO 2材料
理想的LiINiO 2属于六方晶系。氧原子排列成略微扭曲的立方致密结构,锂原子和镍原子交替分布在氧原子层的两侧,占据八面体间隙,如图2所示。层状NiO 2 提供了双-锂原子迁移的三维隧道。因此,层状结构的稳定性决定了LiNiO 2的循环性能。对于LiNiO 2层状化合物,结构稳定性与晶格能有关。因此,OMO键能对LiNiO 2的电化学性能起着至关重要的作用. Ni 3+最外层的3d电子排列为t 6 2g e 1 g .. 根据分子轨道理论(MOT),能量较低的成键轨道已经被占据,其他电子只能占据σ氧原子中的2p,形成的轨道具有更高的能量。这导致Ni-O键的键能减弱。此外,在LiNiO 2的六方层状结构中,NiO 6八面体容易因Jahn-Teller效应而变形。因此,相对而言,LiNiO 2的六方层状结构不如LiCoO 2稳定。在研究 Li 的结构时x NiO 2及其脱锂过程,发现当x=0.7时,晶格由六方晶型R3向单斜晶型转变,当x=0.3时,由单斜晶型向六方晶型R3'转变,而它的晶胞体积缩小。这是因为在充放电过程中,Ni 3+被氧化为Ni 4+ (t 6 2g e 0 g ),NiO 2层的层间引力变大。在Jahn-Teller效应的作用下,NiO 2层收缩引起LiNiO 2相变。因此,LiNiO 2不耐过充。同时,由于Ni 4+具有强氧化性,易与电池中的电解液发生反应,使其热稳定性差。
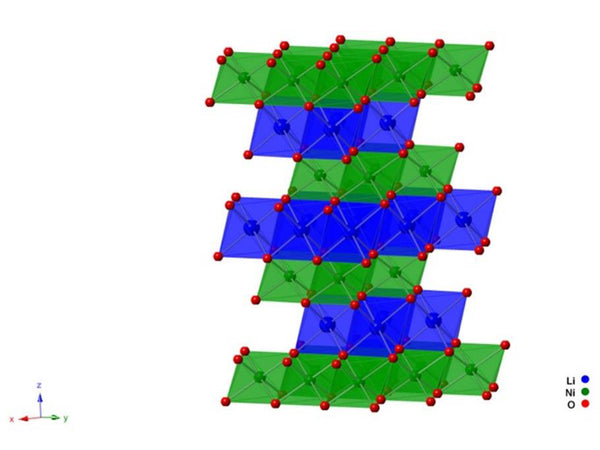
图2 LiNi O 2的晶体结构示意图
现以镍酸锂为例讨论其能带变化与其电化学的相关性。以嵌锂石墨为电池负极,Li C 6 /Ni O 2电池在放电过程中的反应式为
LiC 6 (s)+ NiO 2 (s)→6C+ LiNiO 2 (s)
∆ E r =E(LiNiO 3 )+6E(C)—E(NiO 2 )—E(LiC 6 )
戴斯等人。采用全电位线性化放大平面波法计算了LiC 6 /LiNiO 2的平均开路电压(3.05V) ,比实验值(3.57V)降低了约15%。
有人利用CRYSTAL98程序包中的Hartree-Fock法计算出LiC 6 /LiNiO 2锂离子二次电池的平均电压为4.10V。与实验值3.57V相比,相对误差为+15%。计算表明,NiO 2中Ni和O原子的净电荷分别为2.068和-1.034;LiNiO 2中Li、Ni和O原子的净电荷分别为0.982、1.872和-1.427。比较NiO 2和LiNO 2对应原子上的净电荷表明,在放电过程中,Li嵌入NiO 2后几乎完全电离(净电荷+0.982),而负电荷主要从Li原子转移到O原子,只有少量(-0.196)转移到Ni原子,所以Ni的电荷变化很小,这就解释了实验结果表明LiNiO 2的Jahn-Teller效应很弱。此外,嵌锂中间产物Li 0.5 NiO 2中的锂离子在晶体中有两种可能的扩散路径:直线和折线。计算结果表明,通过折线扩散的势垒很小,这很可能是锂离子扩散的途径。
NiO 2和LiNiO 2的电子态密度如图3所示。从图3可以看出,对于NiO 2 [见图3(a)],费米能级为-3.8au Ni和Li的内轨道费米能级以下能量最低的O位于-0.8至-0.36au范围内,由成键轨道e g、a 1g和t 1u(主要由O的2p轨道贡献)和非键合轨道t 2g (Ni的d xy , d xz和d yz轨道)构成能带,这些能带被完全填满。由反键轨道 e g组成的能带* (Ni's d x²-y² , d z² orbital) 高于费米能级(-0.2~0.4au 区域),未被电子占据。可以看出,最高能量的满带和最低能量的满空带之间存在较大的能隙(0.33au,约9eV),因此可以认为NiO 2 是绝缘体。

图3 Ni O 2和LiNi O 2的电子态密度
从LiNiO 2的电子态密度图(b)可以看出,随着锂原子插入NiO 2,e的g能带向下移动,O的p能带的低能向上移动,表明 O-Ni 键减弱。即,Ni-O 键长从 189.9pm 拉长到 197.9pm 来说明这一点。O和Ni之间σ键的减弱导致反键能带e g *向下移动,费米能位于部分占据的e g *能带的中间。表明 LiNiO 2是导体。从电子结构上解释了锂离子二次电池充放电的可能机理。
3. LiMn 2 O 4材料
Li-Mn-O体系中形成了多种化合物。可用作正极材料的主要材料有LiMn 2 O 4、LiMnO 2、Li 4 Mn 5 O 9和Li 4 Mn 5 O 12。这些化合物在合成和充放电过程中容易发生结构转变,影响材料的电化学性能。负面影响。这里我们介绍尖晶石LiMn 2 O 4的[Mn 2 O 4 ]骨架结构. 该框架是共面四面体和八面体的三维网络。该网络有利于Li原子在其中的扩散,如图4所示。

图4 尖晶石LiMn 2 O 4的晶体结构
如图4所示,尖晶石型LiMn 2 O 4属于Fd3m空间群,锂占据四面体(8a)位,锰占据八面体(16d)位,氧(O)占据面心立方(32e) 位置。因此,其结构可表示为Li 8a [Mn 2 ] 16d O 4. 由于尖晶石结构的晶胞边长是普通面心立方结构的两倍,因此尖晶石结构实际上可以认为是一个复杂的立方结构,包括8个普通的面心立方晶胞。因此,一个尖晶石晶胞有32个氧原子,16个锰原子占据了32个八面体间隙的一半(16d),八面体的另一半(16c)是空的,锂占据了64个四面体间隙。在(8a)的1/8处,可以看出锂原子沿着通道8a-16c-8a通过相邻四面体和八面体的间隙在Mn 2 O 4的三维网络中脱嵌。
在这种结构中,氧原子呈立方紧密堆积,75% 的 Mn 原子交替位于立方紧密堆积的氧层之间,其余 25% 的 Mn 原子位于相邻层中。因此,在脱锂状态下,各层中有足够的Mn离子维持氧原子理想的立方密堆积状态,锂离子可以直接嵌入到由氧原子组成的四面体间隙位。
在Li x Mn 2 O 4中,锂原子的脱嵌范围为0<x≤2,当锂的嵌入或脱嵌范围为0<x≤1.0时,发生反应:
LiMn 2 O 4 =Li 1-x Mn 2 O 4 +xe+Li +
此时Mn的平均价态为3.5~4.0,Jahn-Teller效应不是很明显,因此晶体仍保持其尖晶石结构,对应的Li/Li x Mn 2 O 4输出电压为4.0V,当1.0<x≤2.0时,发生如下反应:
LiMn 2 O 4 +ye+yLi=Li 1+y Mn 2 O 4
当充放电循环电位在3V左右,即1<x<2时,锰的平均价数小于+3.5(即锰离子主要以+3价存在),会造成严重的Jahn-Teller效应,使尖晶石的晶体结构由立方相转变为四方相,c/a值也会增加。这种结构变形破坏了尖晶石骨架。当这种变化的幅度超过一定限度时,就会破坏三维离子迁移通道,锂就会被脱除。包埋困难,导致材料在宏观层面上的电化学循环性能变差。
在具有尖晶石结构的Li x Mn 2 O 4 中,在0<x<1.0的区域,锂离子嵌入过程中不能完全保持单一的尖晶石结构,而是伴随着多次相变。锂离子插入分为三个过程:当0.27<x<0.6时,插入存在于两个立方相之间的反应中;当0.6<x<1.0时,为立方相插入过程;当1.0<x<2.0时,发生立方相和四方相之间的相变。当1>1时,电压急剧下降约1V,这主要是Jahn-Teller畸变引起的,即[MnO 6 ]由对称的O h型变为不对称的D 4h类型。晶相转变存在三相模型:当0<x<0.2时,为立方单相区A;当0.2<x<0.4时,为两相共存区A+B;当0.45<x<0.55时为立方单相区B;0.55 <x<1时为立方单相区。B相和C相之间存在两相共存区(0.55<x<0.95);而对于x=1.0时发生的Jahn-Teller畸变,对晶格构型的破坏较小,对LiMn 2 O 4的循环性能影响较小。
锂离子的嵌入过程并不是依次占据8a位,而是有更复杂的模式。这是因为当锂离子嵌入[Mn 2 O 4 ]的晶格中时,部分Mn 4+被还原为Mn 3+,但尖晶石骨架保持不变。由于四面体8a的位置与四面体空位48f和八面体空位16c共面,四面体空位8a和八面体16d被Mn 4+占据共享四个面,四面体空位48f和16d共享两个面,八面体空位16c与相邻的六个16d共面。在静电力的作用下,插入的锂离子首先进入四面体8a的位置。但是,进入其他空位,需要更大的激活能量。由于每个八面体位置与两个相对面上的8a共面,当x<0.5时,锂离子占据8a位置的一半,类似于[Mn 2 O 4] crystal 与晶格的上层结构有关,即存在子晶格。这时候整个晶体就出现了长程有序,不再是短程有序。碰巧一个子格是满的,而另一个完全是空的。将锂离子插入8a位的一半,将有效降低相邻锂离子之间的排斥力,使锂离子插入后的尖晶石结构能保持最低能态。宏观表现为,当x=1/2时,晶胞参数出现突然跳跃。此时呈现出两相立方密堆积的嵌入过程,反应式为:
[□][Mn 2 ] 16d O 4+1/2Li+ →[□ 1/2 Li 1/2 Mn 2 ] 16d O 4
当0.5<x<1时,锂离子插入另一半的8a位:
[□ 1/2 Li 1/2 Mn 2 ] 16d O 4+1/2Li + →[Li 8a ][Mn 2 ] 16d O 4
当进一步增加插入量时,8a位置已经被填满,插入的锂必须进入八面体的16c位置;此时,[Mn 2 O 4 ]的晶格结构由立方晶变为四方晶,空间群由Fd3m变为F41/adm,发生Jahn-Tellel畸变,由立方相变为四方相。
[Li 8a ][□ 16c ][Mn 2 ] 16d O 4+Li + →[Li 8a ][Li 16c ][Mn 2 ] 16d O 4
4、磷酸系化合物磷酸系化合物正极材料以具有橄榄石结构的LiFePO 4和具有NASICON结构的Li 3 V 2 (PO 4 ) 3
为代表。LiFePO 4具有规则橄榄石结构,属于正交晶系(D 16 2h Pmnb),其结构如图5所示。
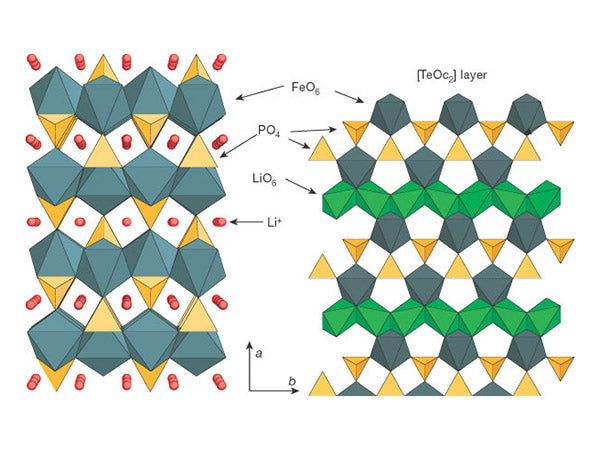
图5 磷酸铁锂三维结构示意图
Li 3 V 2 (PO 4 ) 3是三斜晶系。在其三维结构中,PO 4 3-取代了相对较小的 O 2-,这有助于增加结构的稳定性和加速锂离子的迁移,而离子取代可以通过两个方面来改变电势。一是感应效应,改变离子对,改变金属离子的能级;另一种是提供更多的电子,改变锂离子的浓度,有利于氧化还原反应的发生。在三维结构中,金属八面体和磷酸盐四面体共享氧原子。每个金属钒原子被6个四面体磷原子包围,而四面体磷又被4个钒八面体包围。该结构形成三维结构。在网络结构中,锂原子处于该骨架结构的孔隙中,3个四重晶位为锂原子,导致结构单元中锂原子的 12 个位置。其结构如图6所示。
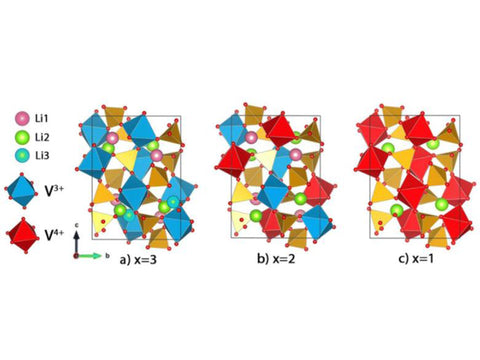
图6 Li 3 V 2 (P O 4 ) 3两种不同晶型的示意图
联系人:余工
手 机:198-5307-5821
邮 箱:batteryltd@sina.com