
锂,化学符号Li,在元素周期表的s区,碱金属;原子序数 3;相对原子质量6.941(2)。金属锂在298K时呈固态,颜色呈银白色或灰色。在空气中,锂会很快失去光泽。
锂是第一周期元素,含有一个价电子(1s 2 2s 1),固态时密度约为水的一半。锂元素的原子半径(经验值)为145pm,原子半径(计算值)为167pm,共价半径(经验值)为134pm,范德华半径为182pm,离子半径为68pm。锂的化学性质如表1所示。
| 元素 | 电子配置 | 金属半径/nm |
电离焓 /(千焦耳/摩尔) 1级 |
12级 /× 10_3 |
熔点 /℃ |
沸点 /℃ |
E⊖① _ /V |
 ̄△ H②diss /(千焦耳/摩尔) |
| 李 | [他]2s | 0.152 | 520.1 | 7.296 | 180.5 | 1356 |  ̄3.02 | 108.0 |
① 反应式Li + (aq)+e=Li(s)。②双原子分子Li 2
的解离能。
由于锂只有一个价电子,因此在紧密堆积的单元电池中其结合能非常弱。金属锂很软,熔点低,因此锂钠合金可用作核反应堆的制冷剂。
锂的熔点和硬度高于其他碱金属,导电性较弱。锂的化学性质与其他碱金属的化学性质不一致。锂的标准电极电位E⊖① ( Li + /Li)在同族元素中很低,这与Li +的水化热较大有关(G)。锂在空气中燃烧时,可直接与氮气作用生成氮化物。这是由于它的离子半径小,对晶格能量的贡献更大。岩石圈中的锂含量很低,主要存在于一些硅酸盐矿物中。锂的密度仅为0.53g/cm 3。在碱金属中,锂的熔点和沸点最高,液程最长,比热容特高。这些特性使其成为热交换中极好的制冷剂。但锂比其他液态金属具有更强的腐蚀性,常用作还原、脱硫、铜及铜合金的脱气剂。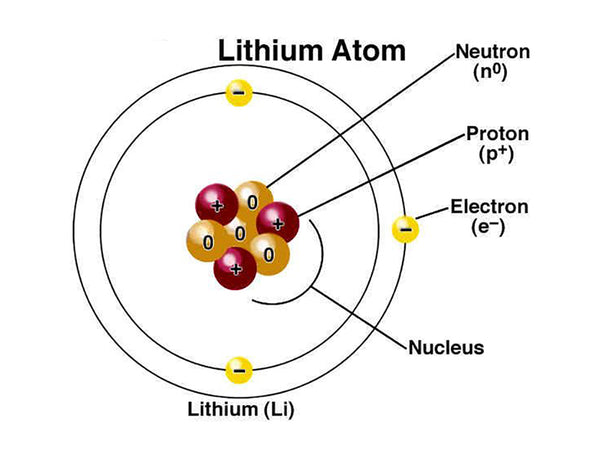
由于锂电子外层的电离焓低,锂离子呈球形,极性低,故锂元素为+1价。与二价镁离子相比,一价锂离子具有特别小的离子半径,因此具有特别高的电荷半径比。与第一主族的其他元素相比,锂的化合物的性质非常反常,与镁的化合物相似。这些反常特性是由于低电荷阴离子的锂盐晶格能量高,特别稳定,而高电荷高价阴离子的盐则相对不稳定。例如,氢化锂的热稳定性高于其他碱金属。LiH 在 900°C 下稳定。LiOH 比其他氢氧化物更难溶解。氢氧化锂在红热下分解;李2 CO 3不稳定。易分解成Li 2 O和CO 2。锂盐的溶解度与镁盐相似。LiF微溶(18℃时0.17g/100g·水),可从氟化铵溶液中析出;Li 3 PO 4难溶于水;LiCl、LiBr、LiI特别是LiClO 4可溶于乙醇、丙酮和乙酸乙酯中,LiCl可溶于嘧啶。LiClO 4的高溶解度是由于锂离子的强溶解度。高浓度溴化锂可溶解纤维素。与其他碱金属硫酸盐不同,Li 2 SO 4不形成同晶化合物。
锂金属的高电极电位显示了其在电池中的应用前景。例如,正极为锂片,负极为由复合过渡金属氧化物材料构成的锂离子二次电池。
在第一主族元素中,与其他物质(氮除外)反应的活性从锂到铯逐渐增加。锂的活性通常是最低的。例如,锂在25℃时与水反应,而钠反应剧烈,钾与水燃烧,铷与铯发生爆炸反应;用液溴,锂和钠反应温和。,而与其他碱金属反应剧烈。锂不能代替C 6 H 5 C≡CH中的弱酸性氢,其他碱金属可以代替。
锂和同族元素之间的基本化学差异是与氧气的反应。碱金属在空气或氧气中燃烧时,锂生成Li 2 O,也有Li 2 O 2,而其他碱金属氧化物(M 2 O)则促进反应。氧化物M 2 O 2和(K、Rb和Cs)超氧化物MO 2。当锂在过量氧气中燃烧时,不会生成过氧化物,但会形成普通氧化物。
锂可以直接与氮结合形成氮化物。锂和氮反应形成红宝石色晶体 Li 3 N(镁和氮形成 Mg 3 N 2);25℃时反应缓慢,400℃时反应迅速。利用这个反应,锂和镁都可以用来去除混合气体中的氮气。当与碳一起加热时,锂和钠反应形成 Li 2 C 2和 Na 2 C 2。重碱金属也能与碳发生反应,但会产生非定量的间隙化合物,这是由于碱金属原子进入薄层石墨中的间隙碳原子所致。
锂和水反应缓慢。氢氧化锂都是中强碱,溶解度很小,加热时可分解成氧化锂。某些锂盐,如氟化物、碳酸盐和磷酸盐,很难溶于水。它们的碳酸盐在加热下可分解成相应的氧化物和二氧化碳。氯化锂均溶于有机溶剂,表现出共价性质。
锂与胺类、醚类、羧酸类、醇类等形成一系列化合物,在众多的锂化合物中,锂的配位数为3-7。
锂的热力学数据如表2所示。
| 状态 |
△H ⊖ f
/(千焦耳/摩尔) |
△G ⊖ f /(千焦耳/摩尔)
|
△S ⊖ f /[ J /(K·mol)] |
△ CP /[ J /(K·mol)] |
H⊖298.15 ﹣ H⊖0 _ _ _ /(千焦耳/摩尔)
|
| 固体状态 | 0 | 0 | 29.12±0.20 | 24.8 | 4.632 ±0.040 |
| 气态的 | 159.3 ±1.0 | 126.6 | 138.782 ±0.010 | 20.8 | 6.197 ±0.001 |
| 气态 (L i 2 ) | 215.9 | 174.4 | 197.0 | 36.1 |
表2 金属锂的部分热力学数据
锂晶体结构的相关数据见表3。
| 空间群 | Im-3m(空间群号:229) |
|||||
| 结构 | bcc(体心立方) | |||||
| 电芯参数 |
一个/下午 351 |
凌晨/下午 351 |
摄氏度/下午 351 |
α/(°) 90.0 |
β /(°) 90.0 |
γ/(°) 90.0 |
锂金属的体心立方结构(bcc)在298K(25℃)条件下最为稳定。一般第一主族(碱金属)的所有元素均以bcc结构为主;Li-Li原子间的最短距离为304pm,锂金属的半径为145pm,说明锂原子间的距离小于钾原子间的距离。在 bcc 晶胞中,每个锂原子都被最近的八个锂原子包围。
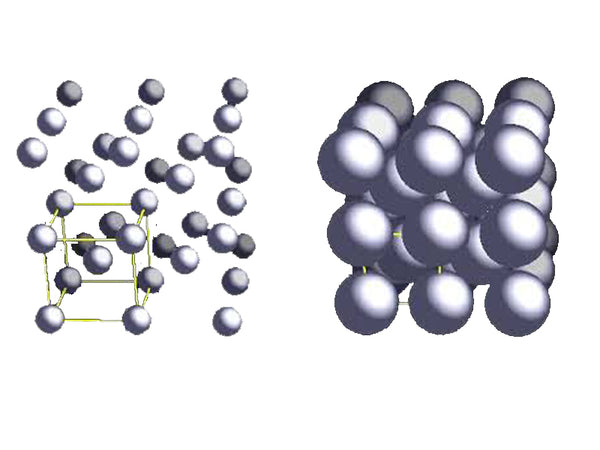
锂金属的体心立方结构(bcc)示意图
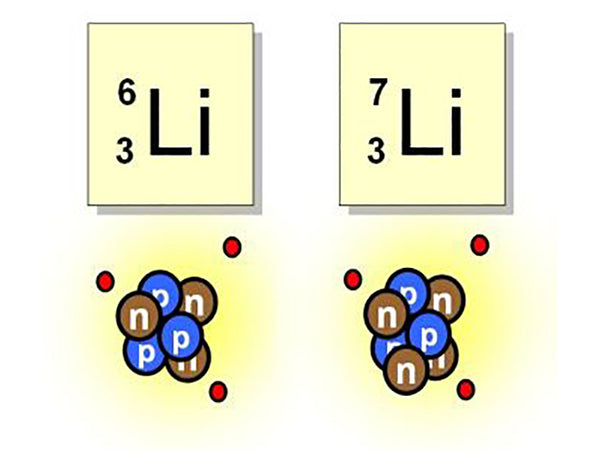
锂的最大用途在于它可以提供一种新型能源。例如,锂的几种同位素6 3 Li 和7 3 Li 很容易被中子轰击并“裂变”产生另一种物质,即氚。这类反应是利用高速粒子(如质子、中子等)或简单原子核(如氘核、氦核)轰击原子核,引起核反应,如:
6 3 Li +1 0 n→ 3 1 H+4 2 He
该反应意味着用中子轰击6 3 Li 以产生氚和氦。
氚可以在热核聚变反应中释放出巨大的能量。锂被用作核聚变或核裂变反应堆的核心制冷剂。例如,氘氚聚变反应中产生的能量有80%以上以中子动能的形式释放出来;锂熔点低,沸点高,热容量和导热系数大。因此,液态锂在反应堆堆芯吸收中子能量,然后循环通过热交换器将水变成蒸汽,从而驱动涡轮发电机发电。另外,当中子照射锂时,会产生氚,并不断地增殖氚。在此过程中,锂是必不可少的热核反应堆燃料。所谓氢弹爆炸就是这种核聚变反应。据测算:1公斤锂所含的能量相当于约2万吨优质煤,可产生至少340万度电,一座100万度的电站一年仅消耗5吨锂。
碱土金属镁的密度为1.74g/cm 3,约为金属铝密度的2/3。由镁和锂制成的镁锂合金,当锂含量达到20%时,其密度仅为1.2g/cm 3, 成为最轻的合金;当锂含量超过5%时,可析出β相,形成(α+β)两相共存结构;当锂含量超过11%时,镁锂合金变为单相,提高了镁锂合金的塑性加工性。在镁锂合金中加入第三元素(如Al、Cu、Zn、Ag或Ce、La、Nd、Y等稀土元素),不仅细化了合金组织,而且大大提高了抗拉强度和延伸率在室温下 率,而高温塑性在一定的变形条件下出现。
金属锂是合成药物的催化剂和中间体,如合成维生素A、维生素B、维生素D、肾上腺皮质激素、抗组胺药等。临床上常使用锂化合物,如碳酸锂、醋酸锂、酒石酸锂、草酸锂、柠檬酸锂、溴化锂、碘化锂、环烷酸锂、尿酸锂等,其中以碳酸锂为主。由于碳酸锂在一般条件下稳定,易于储存,配制容易,所以其中的锂含量较高,口服吸收迅速、完全。如上所述,配制复方锂盐辅以抗抑郁药,对躁郁症有明显疗效。
锂的一些化学反应如下。
(1) 锂与空气的反应。锂金属可以很容易地用刀切割。你可以看到闪亮的银色表面,但由于与空气中的氧气和水蒸气反应,它会很快变成灰色。锂在空气中点燃时,主要产物是白色锂的氧化物Li 2 O。某些过氧化锂 Li 2 O 2也是白色的。
4Li(s)+O 2 (g)→2Li 2 O (s)
2Li(s)+O 2 (g)→Li 2 O 2 (s)
(2) 锂与水反应 金属锂能与水缓慢反应生成无色的氢氧化锂溶液(LiOH)和氢气(H2)。所得溶液呈碱性。由于氢氧化物的形成,反应是放热的。如前所述,反应速度比钠与水的反应慢。
2Li(s)+2H 2 O→2LiOH(aq)+H 2 (g)
(3)锂与卤素反应金属锂能与所有卤素反应生成卤化锂。因此,它可以与F 2、Cl 2、Br 2和I 2反应依次生成一价氟化锂(LiF)、氯化锂(LiCl)、溴化锂(LiBr)和碘化锂(LiI)。反应式如下。
2 Li(s)+F 2 (g)→2LiF(s)
2Li(s)+Cl 2 (g)→2LiCl(s)
2Li(s)+Br 2 (g)→2LiBr(s)
2Li(s)+I 2 ( g)→2LiI(s)
(4)锂与酸反应金属锂易溶于稀硫酸,生成的溶液含有水和水合的一价锂离子、硫酸根离子和氢气等与硫酸反应。
2Li(s)+H 2 SO 4 (aq)→2Li + (aq)+SO 4 2 ̄ (aq)+H 2 (g)
(5)锂与碱反应。金属锂与水缓慢反应生成无色氢氧化锂溶液和氢气。
(H 2 )。当溶液呈碱性时,反应将继续进行。随着反应的进行,氢氧化物浓度增加。
锂是最轻的金属,具有高电极电位和高电化学当量,其电化学比能量密度也相当高。锂的这些独特的物理化学性质决定了它的重要作用。锂化合物作为高能电池正极材料具有显着的性能,如用于充电的锂二次电池,如锂MnO 2、锂Mn 2 O 4、锂CoO 2等电池正极材料。这类电池寿命长,功率大,能量大,可在低温下使用。已应用于国防弹道导弹,将应用于电动汽车等民用领域;LiCl-KCl体系和铝锂合金-FeS体系也被用作大容量电池生产电解液;氢氧化锂用作镍镉等碱性电池的电解液氢氧化钾添加剂。
1990年代初,日本索尼能源开发公司和加拿大摩力能源公司分别开发或研制了新型锂离子电池,不仅性能优良,而且对环境无污染。随着信息技术、便携式机械和电动汽车的快速发展,对高效电源的需求急剧增加,锂电池成为过去发展最快的领域之一。由于锂离子电池的比能量密度和比功率密度是镍隔膜电池的4倍以上,因此近年来锂离子二次电池以年均20%的速度快速发展。美国最近研制的新型聚合物锂离子电池具有体积小、安全可靠等特点,其价格仅为锂离子电池的1/5。目前,正在研发重量比能量密度180W·h/kg、体积比能量360W·h/L、充放电循环500次以上的高能量密度二次锂电池,将在用于电动汽车。预计本世纪前十年,用于锂电池的碳酸锂将超过2万吨。同时,以锂盐为电解质的熔融碳酸盐燃料电池有望成为继磷酸盐燃料电池之后的第二代燃料电池,其发展令人瞩目。价格仅为锂离子电池的1/5。目前,正在研发重量比能量密度180W·h/kg、体积比能量360W·h/L、充放电循环500次以上的高能量密度二次锂电池,将在用于电动汽车。预计本世纪前十年,用于锂电池的碳酸锂将超过2万吨。同时,以锂盐为电解质的熔融碳酸盐燃料电池有望成为继磷酸盐燃料电池之后的第二代燃料电池,其发展令人瞩目。价格仅为锂离子电池的1/5。目前,正在研发重量比能量密度180W·h/kg、体积比能量360W·h/L、充放电循环500次以上的高能量密度二次锂电池,将在用于电动汽车。预计本世纪前十年,用于锂电池的碳酸锂将超过2万吨。同时,以锂盐为电解质的熔融碳酸盐燃料电池有望成为继磷酸盐燃料电池之后的第二代燃料电池,其发展令人瞩目。500多个充放电循环正在开发中,将用于电动汽车。预计本世纪前十年,用于锂电池的碳酸锂将超过2万吨。同时,以锂盐为电解质的熔融碳酸盐燃料电池有望成为继磷酸盐燃料电池之后的第二代燃料电池,其发展令人瞩目。500多个充放电循环正在开发中,将用于电动汽车。预计本世纪前十年,用于锂电池的碳酸锂将超过2万吨。同时,以锂盐为电解质的熔融碳酸盐燃料电池有望成为继磷酸盐燃料电池之后的第二代燃料电池,其发展令人瞩目。

联系人:余工
手 机:198-5307-5821
邮 箱:batteryltd@sina.com