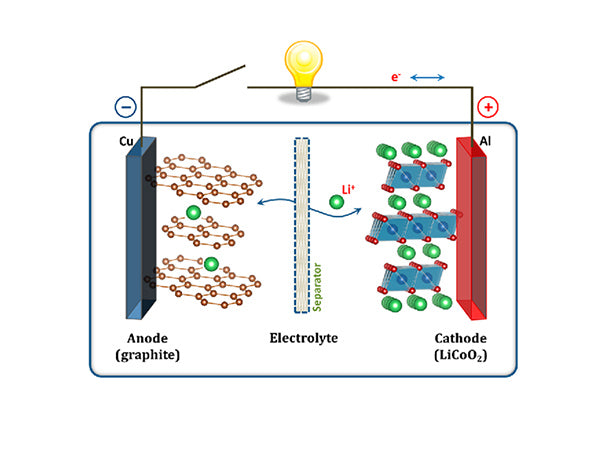
什么是锂离子电池电解液?
电解液是电池的主要成分之一,其作用与电池装置无关。电解质用于电池、电容器和燃料电池设备中,以通过电池在正极和负极之间传输离子。它对电池的容量、工作温度范围、循环性能和安全性能都有重要影响。由于其物理位置在正负极中间,与两个电极密切相关,因此在开发新的电极材料时,支持电解质的开发也必须同时进行。在电池中,正负极材料的化学性质决定了输出能量。对于电解质,在大多数情况下,
根据电解液的形态特征,电解液可分为液体和固体两大类,它们都是具有高离子电导率的物质,在电池内部的正负极之间起到电荷转移的作用。不同类型的电池使用不同的电解质。例如,铅酸电池的电解液使用水溶液;作为锂离子电池的电解液,不能使用水溶液。这是因为水的析氢析氧电压窗口小,不能满足锂离子电池的高要求。电压要求;此外,目前使用的锂离子电池正极材料在水体系中的稳定性较差。
因此,锂离子电池的电解液均采用锂盐的有机溶液作为电解液(如LiPF 6 /EC+DMC)。但是,由于水溶液体系来源方便,电导率较高,研究人员也在努力开发这一领域的新型电解质。
(1)非水系电解液
在锂离子电池制造过程中,选择电解液的一般原则如下:
①良好的化学和电化学稳定性,即基本不与电池体系的正极、负极、集电体、隔膜粘结剂等电极材料发生反应;
②离子电导率高,一般为1×10 -3~2×10 -2 S/cm,介电常数高,粘度低,抗离子迁移能力低;
③高沸点和低凝固点,保持液态的温度范围广,一般温度范围为-40~70℃,适合改善电池的高低温特性;
④加入的溶质溶解度大;
⑤电池正负极循环效率更高;
⑥ 具有良好的综合理化性能,如蒸气压低、化学稳定性好、无毒、不易燃。
除上述要求外,锂离子电池所用电解液一般应满足以下基本要求:
①热稳定性高,在很宽的温度范围内不分解;
②宽电化学窗口,在宽电压范围内保持电化学性能的稳定性;
③与电池其他部分,如电极材料、电极集电体、隔膜等具有良好的相容性;
④任何成分的电解液都易于配制或购买;
⑤ 最能促进电极的可逆反应。
电解质锂盐是锂离子的来源。合适的电解质锂盐应具备以下条件:热稳定性好,不易分解;溶液中离子电导率高;良好的化学稳定性,即不会与溶剂和电极材料发生反应。反应; 电化学稳定性好,阴离子氧化电位高,还原电位低,具有较宽的电化学窗口;分子量低,在合适的溶剂中溶解性好;可使锂在正负极材料中的嵌入量高,可逆性好;电解液成本低。
常用的锂盐有LiClO 4、LiBF 6、LiPF 6、LiAsF 6和一些有机锂盐,如LiCF 3 SO 3、LiC(SO 2 CF 3 ) 3等。在制备电解液的过程中,将上述锂盐溶解在图1的溶剂体系中。1 按一定比例配制锂离子电池电解液。锂离子电池常用的电解液体系有1mol·L -1 LiPF 6 /PC-DEC(1:1)、PC-DMC(1:1)和PC-MEC(1:1)或1mol·L - 1 LiPF6/EC-DEC (1:1)、EC-DMC (1:1) 和 EC-EMC (1:1)。
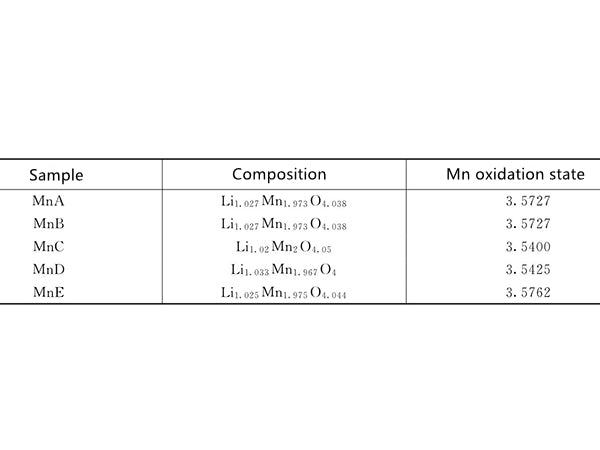
图1 不同组成和Mn氧化态的LiMn2O4样品的组成
由于电解液的离子电导率决定了电池的内阻和不同充放电倍率下的电化学行为,因此对电池的电化学性能和应用非常重要。一般来说,溶解有锂盐的非质子有机溶剂的电导率最高可达2×10-2S/cm,但远低于水系电解质。许多锂离子电池采用混合溶剂体系电解液,可以克服单溶剂体系的一些缺点。电解质配方说明了这一点。当电解质浓度较高时,其导电行为可以用离子对模型来解释。
除了电解液的电导率影响电解液的电化学性能外,电解液的电化学窗口及其与电池电极的反应对电池的性能也很关键。
所谓电化学窗口是指氧化电位E ox和还原电位E red之差。作为电池电解液,首要条件是不与负极和正极材料发生反应。因此,E red应低于金属锂的氧化电位,E ox应高于正极材料的嵌锂电位,即一定不能发生氧化(正)和还原(负)反应广泛的潜力范围。
一般来说,醚类化合物的氧化电位低于碳酸盐。溶剂型二甲醚一般用于原电池。二次电池的氧化电位相对较低。常见的 4V 锂离子电池必须在充电过程中补偿过电位。因此要求电解液的电化学窗口达到5V左右。
此外,测量的电化学窗口与工作电极和电流密度有关。电化学窗口还与有机溶剂和锂盐(主要是阴离子)有关。部分溶剂的氧化反应电位顺序为:DME(5.1V)<THF(5.2V)<EC(6.2V)<AN(6.3V)<MA(6.4V)<PC(6.6V)<DMC(6.7 V)、DEC (6.7V)、EMC (6.7V)。对于有机阴离子,氧化稳定性与取代基有关。F、CF3等吸电子基团的引入,有利于负电荷的分散,提高其稳定性。以玻碳为工作电极,阴离子的氧化安定性大小顺序为:BPh 4 - <ClO 4 - <CF 3 SO 3 - <2 CF 3 ) 2 ] - <C(SO 2 CF 3 ) 3 - <SO 2 C 4 F 9 - <BF 4 - <AsF 6 - < SbF 6 -。
电解液与电极的反应主要是与负极反应,如石墨化碳。从热力学的角度来看,由于有机溶剂中含有CO、CN等型基团,负极材料会与电解液发生反应。例如,以贵金属为工作电极,PC在电压低于1.5V(以锂金属为参比)时发生还原,生成烷基碳酸锂。由于在负极表面形成了一层可以让锂离子通过的保护膜,阻止了负极材料和电解液的进一步还原,所以在动力学上是稳定的。如果使用EMC和EC的混合溶剂,保护膜的性能会进一步提高。
对于碳材料,结构不同,同一电解质组分的电化学行为也不同;对于同一种碳材料,不同电解质组分的电化学行为是不同的。. 例如,对于人造石墨,在PC/EC的1mol/L Li[N(SO 2 CF 3 ) 2 ]溶液中,第一个循环的不可逆容量为1087mA·h/g,而在EC/DEC 1mol/ L Li[ N(SO 2 CF 3 ) 2中的第一不可逆容量]溶液仅为108mA·h/g。与水反应生成LiOH等,可能会失去保护膜的性能,引起电解液继续还原。因此,在有机电解液中,水分含量一般控制在20×10 -6以下。
溶剂与杂质在碳负极上发生的部分反应有以下反应式:
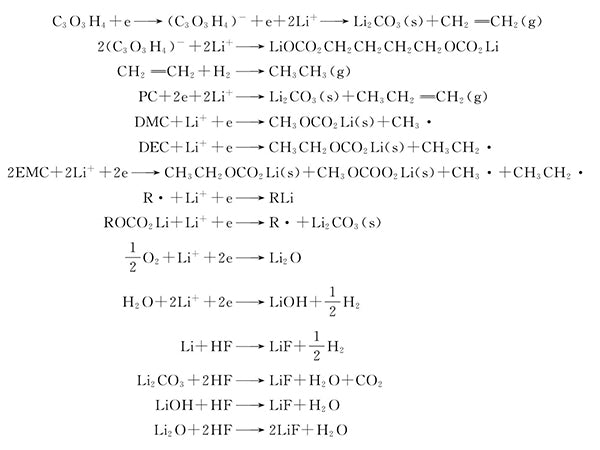
电解液与正极材料之间的反应主要是基于电解液的氧化性。图2显示了丙烯酸碳酸酯基电解液的氧化分解电位随盐的种类和电极材料的变化。为电池电解液体系的设计提供了重要的信息和数据。
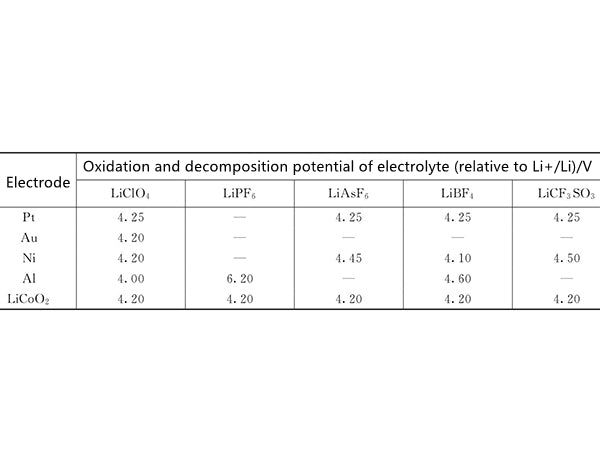
图2 不同盐类和电极材料对丙烯酸碳酸酯基电解液氧化分解电位的影响
电解质锂盐比较活泼,优先发生还原反应,是界面保护膜的主要成分。发生的逐步反应如下:
Li [N(SO 2 CF 3 ) 2 ] +ne+nLi + ---->Li 3 N+Li 2 S 2 O 4 +LiF+ Li y C 2 F x
Li [N(SO 2 CF 3 ) 2 ] +2e+2Li + ---->Li 2 NSO 2 CF 3 +LiSO 2 CF 3
Li 2 S 2 O 4 +4e+4Li---->Li 2 SO 3 +Li 2 S+Li 2 O
(2)固体电解质
聚合物电解质用于锂离子电池已达到商业化水平。聚合物电解质可分为纯聚合物电解质和胶体聚合物电解质。
纯聚合物电解质由于室温电导率低而难以商业化。胶体聚合物电解质是利用液体电解质分子固定在具有合适微结构的聚合物网络中来实现其离子传导。这种类型的电解质具有固体聚合物的稳定性和液体电解质的高离子电导率。良好的应用前景。
胶体聚合物电解质可作为锂离子电池的电解液,也可作为隔膜,但由于其力学性能较差、制备工艺复杂或常温下导电性较差,胶体聚合物电解质本质上是一种热力学不稳定的体系,在开放的环境中或长期存放时,溶剂会从表面渗出,导致其电导率下降。因此,胶体聚合物电解质完全替代了聚乙烯和聚丙烯隔膜,单独作为锂离子电池的隔膜。还有很多问题需要解决。
电池系统中的电解液是离子载体(对电子来说一定是绝缘体)。锂离子电池所用的聚合物电解质满足锂离子电池液态电解质的化学稳定性和电化学稳定性等要求,还应满足以下要求:聚合物薄膜具有优良的加工性能;室温电导率高,低温下锂离子电导率高;良好的高温稳定性,不易燃烧;弯曲性能好,机械强度好。
联系人:余工
手 机:198-5307-5821
邮 箱:batteryltd@sina.com